华声在线12月10日讯(通讯员 刘茜醇 孙执豪)近日,南华大学蛋白质结构与功能实验室林英武教授团队在Nature旗下期刊Communications Biology发表研究性论文,建立了一种同位素19F标记方法,应用天冬酰胺内肽酶OaAEP1在多种金属蛋白的羧基端引入19F,并通过19F核磁共振、X射线单晶衍射和光谱学等手段研究了不同金属蛋白在溶液中的变构效应(如下图)。
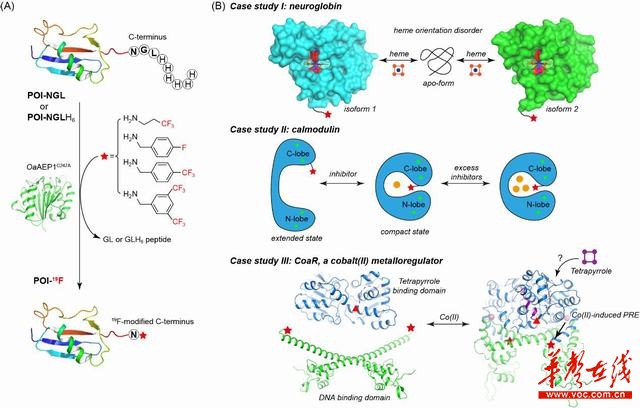
变构效应是许多生物大分子履行其生理功能的关键。目标蛋白质在结合特定金属离子、小分子药物、辅基或效应蛋白后可能会导致构象的大幅度转变,从而实现功能角色的转换。该团队分别研究了具有重要生理功能的不同金属蛋白,包括血红素蛋白Neuroglobin、钙调蛋白Calmodulin和钴离子/咕啉双响应的金属调控蛋白CoaR等,发现19F修饰的羧基端可以作为一个优良的核磁共振探针,用于探测蛋白质结合血红素或金属离子时的变构过程。该方法使用简便、效率高,并且和基因密码子拓展技术兼容,是一种有应用前景的蛋白质修饰方法。
本项研究工作主要由南华大学化学化工学院刘茜醇博士,硕士研究生郭鹏飞和余秋帆完成。化学化工学院林英武教授和刘茜醇博士为共同通讯作者。项目受到国家自然科学基金和湖南省自然科学基金资助。